УДК: 616-001.12-07-08
Мейманалиев Т.С.
Макаланын кыскача мазмуну
Адабияттын баяндамасы өнөкөт тоо оорусунун (ӨТО), ошондой эле негизги бийик тоолуу оорулардын – курч тоо оорусунун (КТО) жана бийик тоолуу өпкө шишигинин (ВООЛ) өнүгүшүнүн патогенезине арналып, ошондой эле бул шарттарды аныктоо, дарылоо жана алдын алуу боюнча маалыматтар берилген. Чет элдик авторлордун маалыматтары менен катар Кыргызстандын окумуштууларынын изилдөөлөрүнүн жыйынтыктарынан да кеңири маалымат берилген.
Негизги сөздөр: бийик тоолуу оорулар, өнөкөт тоо оорусу, курч тоо оорусу, бийик тоолуу өпкө шишиги.
ДИАГНОСТИКА И ЛЕЧЕНИЕ ВЫСОКОГОРНЫХ БОЛЕЗНЕЙ
Мейманалиев Т.С.
Резюме статьи
Литературный обзор посвящен патогенезу развития хронической горной болезни (ХГБ), а также основных острых высокогорных заболеваний – острой горной болезни (ОГБ) и высокогорного отека легких (ВООЛ), представлены также данные по диагностике, лечению и профилактике этих состояний. Наряду с данными зарубежных авторов, представлена обширная сводка результатов исследований ученых Кыргызстана.
Ключевые слова: Высокогорные болезни, хроническая горная болезнь, острая горная болезнь, высокогорный отек легких.
DIAGNOSTICS AND TREATMENT OF HIGH-ALTITUDE DISEASE
Meimanaliev T.S.
Resume of the article
The literature review is devoted to the pathogenesis of the development of chronic mountain sickness (CMS), as well as the main acute high-altitude diseases – acute mountain sickness (AMS) and high-altitude pulmonary edema (HAPE), as well as data on the diagnosis, treatment and prevention of these conditions. Along with the data of foreign authors, an extensive summary of the research results of Kyrgyz scientists is presented.
Keywords: high-altitude diseases, chronic mountain sickness, acute mountain sickness, high-altitude pulmonary edema.
Введение
Земные высоты, поднимающиеся над уровнем моря более чем на 500 м, называют горными местностями. Миррахимов М.М. (1971) предложил следующее разграничение горных поясов.
Низкогорье (от 500 до 1000-1200 м) не оказывает отрицательного влияния на здоровье людей и их трудовую деятельность.
Среднегорье (от 1200-1400 до 2500 м) активирует многие физиологические функции и для адаптации нетренированных людей требуется примерно 6-10 дней.
Высокогорье обжитое (от 2000-2500 до 4000-4500 м) вызывает у большинства людей те или адаптационные расстройства, проявляющиеся, в частности, кратковременным (иногда относительно продолжительным) снижением работоспособности. Течение обычных болезней, как правило, отягощается.
Высокогорье снежное (выше 4000-4500 м) влияет на здоровье людей всегда отрицательно, работоспособность даже тренированных людей значительно снижается.
Netzer N. et al. (2013) приводят следующую классификацию горных высот: высокие (1500-3500 м), очень высокие (3500-5500 м) и экстремально высокие (более 5500 м).
На глобальном уровне на высотах 1500 м и выше проживают более 400 млн человек, а 100 млн жителей низкогорья поднимаются на высоты более 2500 м (Mallet R. et al., 2021). На высотах 2500 м и выше в Азии проживают 80 млн человек и Андах – 35 млн человек, причем большая часть из них обитает на высотах более 3500 м (Penaloza D., Arias-Stella J., 2007).
Основы высокогорной физиологии, как отмечает Whayne T. (2014), были заложены Paul Bert в 1878 году, а хроническая горная болезнь была описана впервые Carlos Monge в 1940 году. Исследованиями Hurtado A. и соавт., проведенными в Перуанских Андах в 1937-1960 годах, были изучены процессы акклиматизации местных горцев. Им были свойственны полицитемия, умеренная легочная артериальная гипертензия (ЛАГ) и низкое системное артериальное давление, а ЭКГ-исследования показали гипертрофию правого желудочка сердца. Эхокардиографическими исследованиями Naeije R. (2018) было показано, что у большинства жителей высокогорья легочное артериальное давление (ЛАД) умеренно повышено и в целом не превышает 25 мм рт. ст.
Быстрый подъем в горы или отсутствие адаптации к ним приводит к горным заболеваниям, к которым относятся острая горная болезнь, высокогорный отек легких и высокогорный отек головного мозга (Paralikar S., 2012). Эти три формы болезней развиваются в течение от нескольких часов до 5 дней после подъема на высоты 2500-3000 м и выше над уровнем моря. У некоторых индивидуумов с высокой чувствительностью к гипоксии острая горная болезнь может возникнуть на высотах менее 2500 м (Luks A. et al., 2017).
Единой классификации высокогорных болезней до настоящего времени не разработано. West J. (2010) приводит следующую классификацию горных болезней, предложенную китайскими учеными (таблица 1).
Таблица 1. Номенклатура и классификация высокогорных болезней (ВГБ), принятая в Китае (West J., 2010)


Anand I., Wu T. (2004) описали подострую горную болезнь, развивающуюся у китайских детей, переместившихся из низкогорья в условия высокогорья Тибета. Она характеризуется тяжелой легочной артериальной гипертензией и сердечной недостаточностью.
Острая горная болезнь
Частота острой горной болезни достигает 30-60% на высотах в 4000-5600 м (Basnyat B. et al., 1999; Schneider M. et al., 2002; Ziaee V. et al., 2003; Gallard S. et al., 2004; Perse C. et al., 2005). По данным Meier D. et al. (2017), острая горная болезнь развивается у 25% индивидуумов, поднявшихся на высоту 3500 м и у 50% – на высоту более 6000 м. Она может прогрессировать от неспецифических симптомов до угрожающей жизни высокогорного отека мозга, возникающего у 1% больных. Избыточная церебральная вазодилатация, возросшая симпатическая активность, сниженная гипоксическая вентиляция, тяжелая гипоксемия, особенно во время сна, повышенная задержка соли и воды способствуют развитию острой горной болезни (Bartsch P. et al., 2004; Burgess K. et al., 2004; MacInnis M. et al., 2015). По данным Richalet J-P. et al. (2012), из 1326 лиц, прошедших гипоксический нагрузочный тест, после подъема на высоту 4000 м у 314 (23,7%) развилась тяжелая форма острой горной болезни, у 22 (1,7%) – высокогорный острый отек легких и у 13 (0,98%) – высокогорный острый отек мозга. Основными факторами риска у лиц, не использовавших ацетазоламид, были предшествующие эпизоды острой горной болезни и мигрени, быстрое восхождение в горы (более 400 м в день) и другие. Независимыми предикторами тяжелой формы острой горной болезни оказались высокий уровень десатуризации и низкий вентиляторный ответ на нагрузочную гипоксию. Labasangzhu G. et al. (2016) отмечают, что из 2385 туристов, посетивших высокогорный город Lhasa (Тибет), расположенный на высоте 3658 м, у 36,7% развилась острая горная болезнь. При этом частота заболевания не зависела от места их жительства, но имела обратную связь с их возрастом. Tang X-G. et al. (2014) считают более старший возраст у китайских мужчин при их быстром восхождении на высоту 3700 м является независимым фактором риска развития острой горной болезни. Однако Wu Y. et al. (2018) на основании проведенного метаанализа не обнаружили ассоциации между возрастом обследованных и риском развития острой горной болезни. McDevitt M. et al. (2014), изучив частоту острой горной болезни среди путешественников, поднимавшихся на высоты 3500-5400 м в Гималаях (Непал), пришли к заключению о том, что за последние 24 года она снизилась благодаря медленному подъему в горы и возросшему приему ацетазоламида. По мнению этих ученых, факторами риска острой горной болезни являются молодой возраст, избыточная масса тела и женский пол. На более высокий риск возникновения острой горной болезни у женщин указывают также Santantonio M. et al. (2014). По данным Lawrence J., Reid S. (2016), при обследовании 175 лиц, поднявшихся на Килиманджаро (Африка) (5895 м), возраст, пол, масса тела и прием ацетазоламида не ассоциировались с риском развития острой горной болезни. Brewster L. et al. (2023) показали увеличение циркулирующих внеклеточных микровезикул в условиях высокогорья, которое приводит к эндотелиальному воспалению и способствует сосудистой дисфункции. Этой же проблеме были посвящены исследования Tymko M., et al. (2019).
Диагноз острой горной болезни (ОГБ) Mairer K. et al. (2009), поставленный на основании головной боли и одного дополнительного симптома по шкале Lake Louise Score ≥4, был обнаружен у 16,2% из 431 туриста, поднимавшегося в горы в восточных Альпах. При этом частота ОГБ нарастала с увеличением высоты местности (2200 м – 6,9%; 2500 м – 9,1%; 2800 м – 17,4% и 3500 м – 38%).
Chen G. et al. (2013) установили высокую корреляцию между двумя системами (Lake Louise Scoring and Chinese Scoring Systems) для постановки диагноза ОГБ у 339 здоровых добровольцев, поднявшихся на высоту 3200 м.
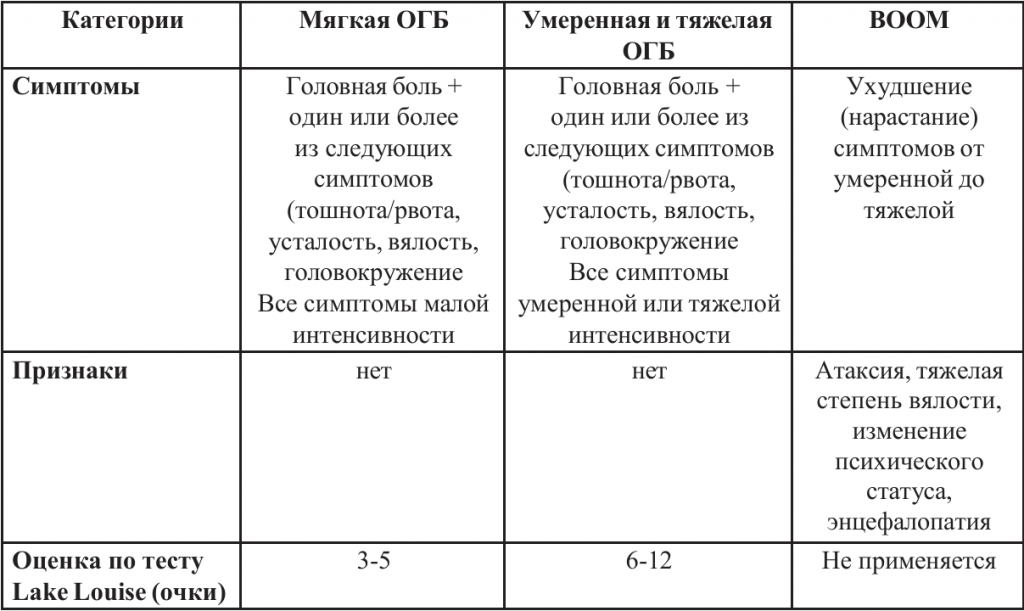
Классификация острой горной болезни, разработанная Luks A. et al. (2019), представлена в таблице 2.
Таблица 2. Классификация острой горной болезни (ОГБ) (Luks A. et al., 2019)
Wu T-Y. et al. (2012), обследовав 200 здоровых некурящих и 182 курильщика, поднявшихся для работы на высоту 4525 м, установили, что курение несколько снижает риск развития ОГБ, но отрицательно влияет на долговременную акклиматизацию к условиям высокогорья.
По данным Estrada N. et al. (2017), ацетазоламид в дозе 250-750 мг в день оказался самым эффективным в лечении острой горной болезни, в то же время действенность ибупрофена, будесонида и дексаметазона остается неясной. Систематический обзор и мета-анализ, проведенный Tang E. et al. (2014), показал, что пероральный прием дексаметазона эффективен для профилактики ОГБ. Сходные данные были получены Ritchie N. et al. (2012) на основе систематического обзора и метаанализа относительно эффективности ацетазоламида в профилактике ОГБ.
Хроническая горная болезнь (ХГБ)
В 1998 году в Японии Международная группа по консенсусу определила хроническую горную болезнь (ХГБ) как синдром, который развивается у лиц, длительно проживающих в условиях высокогорья, и характеризуется избыточным эритроцитозом и гипоксиемией, проходящих при спуске в низкогорье (Reeves J., 1998). У больных ХГБ в Перуанских Андах отмечается также брадикардия (Simpson L. et al., 2021). Различают первичную ХГБ (без идентификации причины) и вторичную (когда определены причины). Кроме того, при ХГБ отмечается высокая ЛАГ (Ge R. et al., 1998).
Международное общество по горной медицине на VI Всемирном конгрессе по горной медицине и высокогорной физиологии в Китае (2004 год) (International Society for Mountain Medicine at the VI World Congress on Mountain Medicine and High Altitude Physiology, Xining, China, 2004) утвердило определение, диагностику, лечение и профилактику подострой и хронической горных болезней (León-Velarde F. et al., 2005). По данным Ge R-L., Helun G. (2001), частота ХГБ среди детей выше, чем среди взрослых и у мужчин выше по сравнению с женщинами. Распространенность ХГБ среди постоянных жителей Тибета обоего пола ниже по сравнению с китайцами, акклиматизированными к условиям высокогорья значительно позже их. По данным Monge C. et al. (1992), в Центральных Андах (4000 м) частота ХГБ достигает 15-20% среди мужчин, возрастая до 30% среди лиц в возрасте 50 лет. Международная группа по консенсусу утвердила ХГБ как клинический синдром, характеризующийся избыточным эритроцитозом, при котором концентрация гемоглобина у мужчин составляет 21 г/дл и у женщин – 21 г/дл (Leon-Velarde F. et al., 2005).
ХГБ и высокогорная легочная артериальная гипертензия (ВЛАГ) достаточно хорошо исследованы в различных горных регионах мира (León-Velarde F., Mejía O., 2008). Избыточный эритроцитоз, легочная гипертензия и расширение правого желудочка сердца являются отличительными признаками ВЛАГ и ХГБ (Corante N. et al., 2018). Dedobbeleer C. et al. (2015) отметили повышенную функцию симпатической нервной системы и сохраненные параметры левого желудочка сердца, однако у больных ХГБ была нарушена диастолическая функция. Длительное пребывание шерпов в условиях высокогорья (5050 м) привело к структурному и функциональному ремоделированию сердца (повышенная функция правого желудочка, нормальная систолическая функция и замедленная диастолическая релаксация левого желудочка) (Stembridge M. et al., 2014). Qian Z. et al. (2020), проведя оценку систолического легочного артериального давления (ЛАД) с помощью эхокардиографии у 120 больных ВЛАГ, выделили три группы в зависимости от уровня: мягкая (30-49 мм рт. ст.), умеренная (50-69 мм рт. ст.) тяжелая (70 и более мм рт. ст.).
Гипертрофия и дилятация правого желудочка сердца являются следствием высокой и устойчивой гипоксической легочной вазоконстрикции, развивающейся в условиях высокогорья (Lankford H., Swenson E., 2014).
Peñaloza D., Sime F. (1971) отмечают, что анатомические, физиологические и клинические характеристики ХГБ (болезнь Монге) схожи с таковыми при хроническом легочном сердце в результате альвеолярной гипоксии. Как отмечают Steele A. et al. (2021), у больных ХГБ, помимо полицитемии, наблюдается протеинурия без нарушения гломерулярной фильтрации. Ge R. et al. (2009) изучили с помощью ЯМР и допплерэхокардиографии структурные и функциональные изменения сердца у 10 младенцев и детей (12-24 месяцев) с ВЛАГ, родившихся и живущих в условиях высокогорья Тибета (3600-4600 м). Результаты исследований показали гипертрофию правого желудочка сердца у всех пациентов. Функция левого желудочка сердца была сохраненной.
Клиническая картина ХГБ в Перуанских Андах отличается от таковых в Китае и Кыргызстане (Penaloza D., Arias-Stella J., 2007). При ЭКГ-исследовании 741 мужчины высокогорья Тянь-Шаня и Памира признаки cor pulmonale были выявлены у 14% обследованных. Повышенное ЛАД (более 25 мм рт. ст.) установлено у 20% из 136 обследованных мужчин (Mirrakhimov M., Winslow R., 1996). По данным Maripov A. et al. (2013), у больных ВЛАГ обнаруживается тяжелая правожелудочковая дисфункция с помощью обычной эхокардиографии.
Имеются сведения о вкладе генетических факторов в патогенез этих заболеваний. Так, описана более частая встречаемость некоторых аллелей у шерпов и кыргызов (G allele of eNOS polymorphism Glu298Asp in Sherpas and ACE I allele in Kyrgyz) и редкая встречаемость ACE D аллеля у горных жителей в Андах (Aldashev A. et al., 2002; Droma Y. al., 2006; MacInnis M. et al., 2010; Wang P. et al., 2010). Gilbert-Kawai E. et al., (2014) отмечают исключительную устойчивость тибетцев и шерпов к условиям высокогорья, возможно, благодаря естественному отбору и формированию особого генотипа/фенотипа в течение сотен поколений людей, проживших на таких экстремальных высотах. Villafuerte F. (2015) рассматривает одним из генетических факторов избыточного эритроцитоза и ХГБ ген сентрин-специфическую протеазу 1 (sentrin-specific protease 1, SENPI). Учитывая, что только отдельные индивидуумы заболевают ВЛАГ Mirrakhimov A., Strohl K. (2016) считают, что генетические факторы играют существенную роль в патогенезе данной патологии. По мнению авторов, клиническая картина ВЛАГ неспецифична и включает усталость, кашель, затрудненное дыхание, снижение памяти и умственной работоспособности, гепатоспленомегалию и правожелудочковую сердечную недостаточность. К факторам риска ВЛАГ относятся курение, загрязнение воздуха в помещениях и нарушение дыхания во время сна. Авторы рекомендуют ЭКГ, эхокардиографию и рентгенологическое исследование как методы скрининга для диагностики ВЛАГ. Решающим методом выявления болезни является катетеризация правой половины сердца, при которой ЛАД превышает 30 мм рт. ст.
Для лечения рекомендуется перемещение больных в условия низкогорья, оксигенотерапия и использование медикаментов (антагонисты эндотелиальных рецепторов, ацетазоламид, фазудил, блокаторы фосфодиэстары-5).
Peng W. et al. (2023), обследовав 33 больных ХГБ, 33 здоровых горца и 33 здоровых жителя низкогорья с помощью ЯМР, выявили значительное снижение бивентрикулярной фракции выброса, нарушение функции правого и левого желудочков сердца у больных ХГБ. По данным авторов, индуцированный гипоксией эритроцитоз является причиной нарушения функции левого желудочка, а азот мочевины крови – независимым фактором ремоделирования правого желудочка сердца. По мнению Xu X., Jing Z. (2009), сниженная продукция оксида азота является одним из механизмов развития ВЛАГ, в то время как роль endothelin-1 и prostaglandin I2 нуждается в дальнейших исследованиях, также как ряда генетических факторов. Эхокардиография считается весьма полезным скрининговым методом, а катетеризация правого желудочка сердца – золотым стандартом диагностики ВЛАГ.
Идеальным методом лечения ВЛАГ является спуск больных в условия низкогорья. Фосфодиэстераза-5 и ацетазоламид наиболее эффективны в лечении ВЛАГ. Что касается антагонистов эндотелиевых рецепторов, то не получены убедительные доказательства их эффективности при ВЛАГ (Xu X., Jing Z., 2009).
В мире более 140 млн человек живут на высотах 2500 м и выше, а в Кыргызской Республике – более 200 тыс. человек (Aldashev A. et al., 2002; Penaloza D., Arias-Stella J., 2007; Lichtblau M. et al., 2020). Кыргызские горцы освоили горы Тянь-Шаня и Памира в IX-X веках, что было позднее по сравнению с прибытием людей на Тибет. Поэтому они менее адаптированы к условиям высокогорья, чем горцы Тибета (Aldashev A. et al., 2002). Частота ВЛАГ составляет от 6% при использовании определения данной патологии, предложенной экспертами на основе консенсуса, и 35% – при определении ЛАГ, применяемой для жителей низкогорья (Lichtblau M. et al., 2020). По оценочным данным ряда ученых (Mirrakhimov M., 1985; Kojonazarov B. et al., 2007; Penaloza D., Arias-Stella J., 2007) ВЛАГ, осложненная ХГБ, выявляется у 5-10% горцев. Latshang T. et al. (2017) у кыргызских горцев выявили сочетание ВЛАГ с апноэ сна, сниженные когнитивную деятельность, физическую работоспособность и качество жизни. По данным Sydykov A. et al. (2021), в условиях высокогорья длительное холодовое воздействие является дополнительным фактором в развитии ВЛАГ и гипертрофии правого желудочка сердца, сердечной недостаточности и преждевременной смерти больных. При ЭКГ-исследовании 741 мужчины высокогорья Тянь-Шаня и Памира признаки cor pulmonale были выявлены у 14% обследованных (Mirrakhimov M., Winslow R., 1996).
Высокогорный отек легких
В течение столетий высокогорный отек легких (ВОЛ) диагностировался неверно и чаще всего молодым, энергичным людям, внезапно умершим после пребывания в условиях высокогорья, ставился диагноз пневмония (Paralikar S., 2012). Как отмечают Миррахимов М.М., Мейманалиев Т.С. (1984), Singh I. et al. (1965) и Paralikar S. (2012), первые сообщения о ВОЛ принадлежат д-ру Jacottet, Mosso A. (1891) и Durig A., Zuntz N. (1904). Во время экспедиции в Каракорум (Пакистан) в 1902 году Crowley A. описал отек легких и потерю сознания у альпиниста (Auerbach P., 2007). Согласно Houston C. (1960), в Андах врачи были знакомы с ВОЛ в отличие от их коллег из англоязычных стран. Ситуация изменилась в 1960 году, когда было сообщение о развитии ВОЛ у здорового 21-летнего лыжника США, поднявшегося на высоту 3650 м. У него на рентгенограмме были обнаружены признаки отека легких, а на ЭКГ не было каких-либо отклонений. Hultgren H. при катетеризации сердца у 7 больных с ВОЛ в больнице Chulec (Перу) установил легочную гипертензию, снижение сердечного выброса и низкое легочное давление окклюзии (Hultgren H., Spickard W., 1960). Описаны также случаи ВОЛ среди военных Индии, дислоцированных в Гималаях (Singh I. et al., 1965; Menon N., 1965). Первый случай ВОЛ у индейца Южной Америки развился во время одного из его подъемов от уровня моря (Лима) в Касапалку (Casapalca), находящуюся на высоте 4165 м (Hurtado A., 1937). Наблюдения Singh I. et al. (1965) охватили 332 мужчин в возрасте 18-53 лет в Индии. 249 обследованных прибыли в высокогорье впервые и 83 – повторно после 1-196 дней проживания на уровне моря. ВОЛ развилось у 208 из 332 в течение 3-х дней после прибытия в высокогорье, у 84 – на 4-10 дни и остальные 40 – на 11-240 дни. В Перуанских Андах все случаи ВОЛ возникали в течение 9-36 часов после прибытия на высоты. В целом частота ВОЛ составила 15,5% у лиц, впервые поднявшихся в горы, и 13% – у повторно поднимающихся.
По оценочным данным Sopocles A. (1986) ВОЛ развивается у 0,01-0,1% посетителей высокогорных лыжных центров в Скалистых горах в Колорадо (США). Частота ВОЛ у восходителей в Альпах составляет менее 0,2% (Hochstrasser J. et al., 1986). Однако, по данным Hackett P., Rennie R. (1979) и Maggiorini M. et al. (1990), у альпинистов в Гималаях и Швейцарских Альпах она достигает 4%. У 15% индийских солдат ВОЛ развивался на высоте 5500 м (Singh I., Roy S., 1969).
В возникновении ВОЛ придается значение воздействию всего горно-климатического комплекса и, прежде всего, фактора гипоксии (Миррахимов М.М., Мейманалиев Т.С., 1984).
При этом существенную роль играют следующие механизмы:
- повышение легочного артериального давления,
- повышение проницаемости капилляров,
- усиление свертывающей системы крови (тромбообразование),
- активация гормональной функции надпочечников и нарушение электролитного баланса организма,
- клеточные факторы и изменение сурфактантной системы в легких (Swenson S. et al., 2002; Maggiorini M., 2006; Murray F. et al., 2006).
ВОЛ является некардиогенным заболеванием и обычно развивается у жителей низкогорья, быстро поднявшихся на высоты более 2500-3000 м. Однако данная патология может развиться у жителей высокогорья после их пребывания в условиях низкогорья (Paralikar S., 2012). По данным Scherrer U. et al. (2010), два фундаментальных механизма определяют развитие ВОЛ:
- количество вытекающей жидкости из легочной сосудистой сети и
- скорость её выведения альвеолярным эпителием.
К ранним симптомам ВОЛ относятся кашель, диспноэ при физических усилиях и ограниченная физическая активность. Позже диспноэ наступает в покое. Клиническими проявлениями являются цианоз, тахикардия, тахипноэ и повышение температуры тела до 38,5°C. Тахикардия может превышать 120 ударов в минуту, пульс очень слабый, нитевидный (Hultgren H., 1965).
Хрипы вначале прерывистые и слышатся в средней части легких. ВОЛ развивается в результате резко возросшей гипоксической легочной вазоконстрикции и повышения ЛАД. Важное значение имеет также высокая проницаемость легочных капилляров.
Singh I. et al. (1965) выделили следующие клинические типы ВОЛ:
- начало с острой горной болезнью;
- коварное начало;
- острый респираторный синдром;
- начало с мочевым синдромом;
- церебральная форма,
- отсутствие инфекции и
- отсутствие застойной сердечной недостаточности.
У 261 из 332 обследованных больных отмечалось начало с проявлений острой горной болезни: недомогание, диспноэ или сухой кашель. Это указывало на приближающийся отек легких. При коварном начале у больных в течение нескольких часов развивались недомогание, боли в икроножных мышцах, головная боль, тревожность и возбуждение, затем одышка, сухой кашель с или без сердцебиения с последующей полной картиной отека легких. Острый респираторный синдром проявляется прогрессирующим кашлем и одышкой. Появляется цианоз лица и конечностей. Слышны крепитирующие хрипы в груди. Они не симметричны и появляются в одном или обоих легких в межлопаточной области и обычно распространяются в верхние зоны. При молниеносных формах больные задыхаются, хрипы слышны на расстоянии. Быстро наступает агония. Начало с мочевыми симптомами проявляется частым мочеиспусканием на фоне олигурии. При церебральной форме наблюдаются головокружение, галлюцинации и безразличие к окружающему. При всех вышеописанных клинических вариантах ВООЛ отсутствуют инфекции и застойная сердечная недостаточность.
Как отмечают Hackett P., Oelz O. (1992), в 1991 году на Международном симпозиуме по гипоксии в Канаде был принят консенсус (The Lake Louise Consensus) относительно определения и количественной оценки горных заболеваний. Согласованы следующие диагностические критерии. Для острой горной болезни характерно наличие головной боли и одного из нижеперечисленных симптомов: гастроинтестинальные (анорексия, тошнота или рвота), усталость или слабость, головокружение или дурнота, затрудненное засыпание. Высокогорный отек мозга рассматривается как последняя или тяжелая стадия острой горной болезни. Наблюдаются изменения в психическом состоянии и/или атаксия у больных с острой горной болезнью или наличие обоих перечисленных симптомов у больных без острой горной болезни. При ВООЛ отмечаются по крайней мере два из следующих симптомов: одышка в покое, кашель, слабость или сниженная физическая работоспособность, стеснение или заложенность в груди. Характерны два из следующих объективных признаков: хрипы или свист в одном из легких, центральный цианоз, тахипноэ, тахикардия. Maggiorini M., Léon-Velarde F. (2003) указывают, что ЛАГ является отличительным признаком высокогорного отека легких и застойной правожелудочковой застойной сердечной недостаточности при подострой и хронической горной болезни в Гималаях и последней стадии болезни Монге в Андах. На ренгенограммах видны неоднородные помутнения без преобладания в расположении, но чаще в правой средней доле легкого (Bartsch P. et al., 2003; Schoene R., 2008). Исследования Maggiorini M., Léon-Velarde F. (2003) свидетельствуют о том, что чрезмерно повышенные легочное артериальное давление и/или проток крови в легочные капилляры приводят к альвеолярному кровотечению, являющемуся патофизиологическим механизмом острого высокогорного отека легких. В Гималаях развитие высокогорного острого отека легких было успешно предотвращено благодаря продлению периода акклиматизации людей от нескольких дней до 5 недель. Однако это не предупреждает возникновение застойной правожелудочковой недостаточности после нескольких недель пребывания на высоте 6000 м (Maggiorini M., Léon-Velarde F., 2003).
Без лечения смерть от ВООЛ может наступить в течение 6-48 часов (Hultgren H., 1965). При лечении данного заболевания показана высокая эффективность нифедипина и кислородной терапии, в том числе, с использованием сумки Гамова (Gamov bag) (Paralikar S., 2012). Эффективность нифедипина при ВООЛ была изучена ранее Oelz O. et al. (1989) и Bartsch P. et al. (1991).
Профилактический прием ацетазоламида снижал риск тяжелой формы острой горной болезни на 44% (Richalet J-P. et al., 2012). Показана также эффективность тадалафила (Luks A. et al., 2017). Mazur K. et al. (2020) на основе анализа литературных данных за последние 30 лет пришли к заключению о том, что наиболее эффективным методом профилактики ВОЛ являются постепенное восхождение в горы. Berger M. et al. (2023), обследовав 1370 альпинистов на различных высотах западных Альп (3650 м и выше), отметили, что лучшие знания об острой горной болезни и высокогорном остром отеке мозга не предотвращают их возникновение.
Luks A. et al. (2019) опубликовали клинические практические руководства медицинского общества Wilderness (Wilderness Medical Society), основанные на доказательной медицине, по профилактике и лечению острой горной болезни, высокогорного отека мозга и легких. В этих руководствах изложены следующие лекарственные препараты и их дозы.
Для профилактики острой горной болезни и высокогорного отека мозга рекомендованы ацетазоламид 125 мг каждые 12 часов взрослым и 2,5 мг/кг каждые 12 часов детям перорально и при лечении – ацетазоламид 250 мг каждые 12 часов взрослым и 2,5 мг/кг каждые 12 часов детям.
Дексаметазон для профилактики острой горной болезни и высокогорного отека мозга назначается по 2 мг каждые 6 часов или по 4 мг каждые 12 часов перорально, не рекомендуется детям. При лечении острой горной болезни данный препарат используется перорально в дозе 4 мг каждые 6 часов и при высокогорном отеке мозга 8 мг однократно, затем по 4 мг каждые 6 часов, а детям по 0,15 мг/кг каждые 6 часов (максимум 4 мг в сутки).
Нифедипин для профилактики и лечения острой горной болезни и высокогорного отека легких рекомендуется по 30 мг каждые 12 часов или по 20 мг каждые 8 часов перорально.
Ибупрофен по 600 мг каждые 8 часов применяется для профилактики острой горной болезни. Тадалафил по 10 мг каждые 12 часов и силденафил по 50 мг каждые 8 часов перорально назначается только для профилактики высокогорного отека легких.
Список литературы
- Миррахимов М.М. Болезни сердца и горы // Фрунзе, 1971. – 310 с.
- Миррахимов М.М., Мейманалиев Т.С. Высокогорная кардиология // Фрунзе, 1984. 306 с.
- Aldashev A., Sarybaev A., Sydykov A. et al. Characterization of high-altitude pulmonary hypertension in the Kyrgyz: association with angiotensin-converting enzyme genotype // American Journal of Respiratory and Critical Care Medicine, 2002,166 (10). – p. 1396-1402
- Anand I., Wu T. Syndromes of subacute mountain sickness // High Altitude Medicine and Biology, 2004, 5 (2). – p. 156-170
- Auerbach P. Wilderness Medicine // 5th ed. Philadelphia: Mosby Elsevier; 2007
- Bartsch P., Maggiorini M., Ritter M. et al. Prevention of high-altitude pulmonary edema by nifedipine // New England Journal of Medicine, 1991, 325. – p. 1306-1307
- Bartsch P., Mairbauri H., Swenson E., Maggiorini M. High altitude pulmonary edema // Swiss Medicine Weekly, 2003,133. – p. 377-384
- Bartsch P., Bailey D., Berger M. et al. Acute mountain sickness: controversies and advances // High Altitude Medicine and Biology, 2004, 5 (2). – p. 110-124
- Basnyat B., Lemaster J., Litch J. Everest or bust: a cross sectional, epidemiological study of acute mountain sickness at 4243 m in the Himalayas // Aviation Space and Environmental Medicine, 1999, 70. – p. 867-873
- Berger M., Hüsing A., Niessen N. et al. Prevalence and knowledge about acute mountain sickness in the Western Alps // PLoS One, 2023, 18 (9). – e0291060
- Brewster L., Bain A., Garcia V. et al. Global REACH 2018: high altitude-related circulating extracellular microvesicles promote a proinflammatory endothelial phenotype in vitro // High Altitude Medicine and Biology, 2023, 24.- p. 223-229
- Burgess K., Johnson P., Edwards N., Cooper J. Acute mountain sickness is associated with sleep desaturation at high altitude // Respirology, 2004, 9 (4). – p. 485-492
- Chen G., Qin J., Yu J. et al. Incidence of acute mountain sickness in young adults at 3200 meters: comparison of the Lake Louise Scoring and Chinese Scoring Systems // Genetic and Molecular Research, 2013, 12 (4). – p. 6790- 6801
- Corante N., Anza-Ramírez C., Figueroa-Mujíca R. et al. Excessive erythrocytosis and cardiovascular risk in Andean Highlanders // High Altitude Medicine and Biology, 2018, 19 (3). – p. 221-231
- Dedobbeleer C., Hadefi A., Pichon A. Left ventricular adaptation to high altitude: speckle tracking echocardiography in lowlanders, healthy highlanders and highlanders with chronic mountain sickness // International Journal of Cardiovascular Imaging, 2015, 31 (4). – p. 743 752
- Droma Y., Hanaoka M., Basnyat B. et al. Genetic contribution of the endothelial nitric oxide synthase gene to high altitude adaptation in sherpas // High Altitude Medicine and Biology, 2006, 7 (3). – p. 209-220
- Durig A., Zuntz N. Archive of Anatomy and Physiology, 1904. – p. 417
- Estrada N., Franco M., Medina R. et al. Interventions for preventing high altitude illness: Part I. Commonly-used classes of drugs // Cochrane Database Systematic Review, 2017, 6 (6). – CD009761
- Gallard S., Dellasanta P., Loutan L., Kayser B. Awareness, prevalence, medication use, and risk factors of acute mountain sickness in tourists trekking around the Annapurnas in Nepal: a 12-year follow-up // High Altitude Medicine and Biology, 2004, 5. – p. 410-419
- Ge R., Kubo K., Kobayashi T. Definition and classification of chronic mountain sickness in China // In: Ohno H, Kobayashi T, Masuyama S, Nakashima M, eds. Progress in Mountain Medicine and High Altitude Physiology. Matsumoto, Japan; 1998. – p. 149–152
- Ge R., Helun G. Current concept of chronic mountain sickness: pulmonary hypertension- related high-altitude heart disease // Wilderness and Environmental Medicine, 2001, 12 (3).– p. 190-194
- Ge R., Ma R., Bao H. et al. Changes of cardiac structure and function in pediatric patients with high altitude pulmonary hypertension in Tibet // High Altitude Medicine and Biology, 2009, 10 (3). – p. 247-252
- Gilbert-Kawai E., Milledge J., Grocott M., Martin D. King of the mountains: Tibetan and Sherpa physiological adaptations for life at high altitude // Physiology (Bethesda), 2014, 29 (6). – p. 388-402
- Hackett P., Rennie R. Peripheral edema, retinal haemorrhage and acute mountain sickness // American Journal of Medicine, 1979, 67. – p. 214-218
- Hackett P., Oelz O. The Lake Louise Consensus on the definition and quantification of altitude illness // In: Hypoxia and Mountain Medicine. J. Sutton, C. Houston, G. Coates, eds. Queen City Press, Burlington, VT, 1992. – p. 327-330
- Hochstrasser J, Nanzer A, Oelz O. Altitude edema in the Swiss Alps. Observations on the incidence and clinical course in 50 patients, 1980-1984 // Schweizerische Medizinische Wochenschrift, 1986, 116. – p. 866-873
- Houston C. Acute pulmonary edema of high altitude // New England Journal of Medicine, 1960, 263. – p. 478-480
- Hultgren H., Spickard W. Medical experiences in Peru // Stanford Medical Bulletin, 1960, 18.– p. 76-95
- Hultgren H. Treatment and prevention of high altitude pulmonary edema // The American Alpine Journal, 1965. – p. 363-372
- Hurtado A. Aspectos Fisiopatologicos y Patologicos de la Vida en la Altura, Lima, 1937. – p. 30
- Kojonazarov B., Imanov B., Amatov T. et al. Noninvasive and invasive evaluation of pulmonary arterial pressure in highlanders // European Respiratory Journal, 2007, 29. – p. 352–356
- Labasangzhu G., Nafstad P., Stigum H. et al. Acute mountain sickness among toutists visiting the high-altitude city of Lhasa at 3658 m above sea level: a cross-sectional study // Archives of Public Health, 2016, 74. – p. 23-28
- Lankford H., Swenson E. Dilated hearts at high altitude: words from on high // High Altitude Medicine and Biology, 2014, 15 (4). – p. 511-519
- Latshang T., Furian M., Aeschbacher S. et al. Association between sleep apnoea and pulmonary hypertension in Kyrgyz highlanders // European Respiratory Journal, 2017, 49. 1601530
- Lawrence J., Reid S. Risk determinants of acute mountain sickness and summit success on a 6-day ascent of Mount Kilimanjaro (5895 m) // Wilderness and Environmental Medicine, 2016, 27 (1). – p. 78-84
- León-Velarde F., Maggiorini M., Reeves J. et al. Consensus statement on chronic and subacute high altitude diseases // High Altitude Medicine and Biology, 2005, 6 (2). – p. 147-157
- León-Velarde F., Mejía O. Gene expression in chronic high altitude diseases // High Altitude Medicine and Biology, 2008, 9 (2). – p. 130-139
- Leshem E., Caine Y., Rosenberg E. et al. Tadalafil and acetazolamide versus acetazolamide for prevention of severe high-altitude illness // Journal of Travel Medicine, 2012, 19 (5). – p. 308-310
- Lichtblau M., Saxer S., Furian M. et al. Cardiac function and pulmonary hypertension in Central Asian highlanders at 3250 m // European Respiratory Journal, 2020, 56 (2). 1902474
- Luks A., Swenson E., Bartsch P. Acute high-altitude sickness // European Respiratory Review, 2017, 26. – 160096
- Luks A., Auerbach P., Freer L. et al. Wilderness Medical Society clinical practice guidelines for the prevention and treatment of Acute Altitude Illness: 2019 Update // Wilderness and Environmental Medicine, 2019, 30 (4S). – S3-S18
- MacInnis M., Koehle MS. Rupert J. Evidence for a genetic basis for altitude illness: 2010 update // High Altitude Medicine and Biology, 2010, 11 (4). – p. 349-368
- MacInnis M., Lohse K., Strong J., Koehle M. Is previous history a reliable predictor for acute mountain sickness susceptibility? a meta-analysis of diagnostic accuracy // British Journal of Sports and Medicine, 2015, 49 (2). – p. 69-75
- Maggiorini M., Buhler B., Walter M., Oelz O. Prevalence of acute mountain sickness in the Swiss Alps // BMJ, 1990, 301. – p. 853-855
- Maggiorini M., Léon-Velarde F. High-altitude pulmonary hypertension: a pathophysiological entity to different diseases // European Respiratory Review, 2003, 22 (6). – p. 1019-1025
- Maggiorini M. High altitude-induced pulmonary edema // Cardiovascular Research, 2006, 72.– p. 41-50
- Mairer K., Wille M., Bucher T., Burtscher M. Prevalence of acute mountain sickness in the Eastern Alps // High Altitude Medicine and Biology, 2009, 10 (3). – p. 239-245
- Mallet R., Butscher J., Richalet J-P. et al. Impact of high altitude on cardiovascular health: current perspectives // Vascular Health and Risk Management, 2021, 17. – p. 317-335
- Maripov A., Mamazhakypov A., Karagulova G. et al. High altitude pulmonary hypertension with severe right ventricular dysfunction // International Journal of Cardiology, 2013, 168 (3). – e89–e90
- Mazur K., Machaj D., Jastrzebska S. et al. Prevention and treatment of high altitude edema // Journal of Education, Health and Sport, 2020, 10 (2). – p. 114-119
- McDevitt M., McIntosh S., Rodway G. et al. Risk determinants of acute mountain sickness in trekkers in the Nepali Himalaya: a 24-year follow-up // Wilderness and Environmental Medicine, 2014, 25 (2). – p. 152-159
- Meier D., Collet T-H., Locatelli I. et al. Does this patient have acute mountain sickness? The rational clinical examination systematic review // JAMA, 2017, 318 (18). – p. 1810-1819
- Menon N. High altitude pulmonary edema: A clinical study // New England Journal of Medicine, 1965, 273. – p. 66-73
- Mirrakhimov M. Chronic high-altitude cor pulmonale // In: Pulmonary Arterial Hypertension. Transactions of the International Symposium on Pulmonary Arterial Hypertension, Frunze, Kyrgyzstan. Kyrgyz Institute of Cardiology, 1985, 7
- Mirrakhimov M., Winslow R. The cardiovascular system at high altitude. the Kyrgyz population may be under greater control from other // In: Fregley M, Blatteal C, editors. Environmental physiology. Oxford: Oxford University Press; 1996. – p. 1241-1258
- Mirrakhimov A., Strohl K. High-altitude pulmonary hypertension: an update on disease pathogenesis and management // Open Cardiovascular Medicine Journal, 2016, 10. – p. 19-27
- Monge C., Arregui A., Leon-Velarde F. Pathophysiology and epidemiology of chronic mountain sickness // International Journal of Sports and Medicine, 1992, 13 (1). – p. S79 S81
- Mosso A. Life of man in the high Alps. London, 1898
- Murray F., Insel P., Yuan I. Role of O(2)-sensitive K(+) and Ca (2+) channels in the regulation of pulmonary circulation: Potential role of caveolae and implications for high altitude pulmonary edema // Respiratory Physiology and Neurobiology, 2006, 151. – p. 192-208
- Naeije R. Altitude and the right heart // Revue des Maladies Respiratoires, 2018, 35 (4). – p. 441-451
- Netzer N., Strohl K., Faulhaber M. et al. Hypoxia-related altitude illnesses // Journal of Travel Medicine, 2013, 20 (4). – p. 247-255
- Oelz O., Maggiorini M., Ritter M. et al. Nifedipine for high altitude pulmonary edema // Lancet, 1989, 2. – p. 1241-1244
- Paralikar S. High altitude pulmonary edema – clinical features, pathophysiology, prevention, and treatment // Indian Journal of Occupational and Environmental Medicine, 2012, 16 (2).– p. 59-62
- Peñaloza D., Sime F. Chronic cor pulmonale due to loss of altitude acclimatization (chronic mountain sickness) // American Journal of Medicine, 1971, 50 (6). – p. 728-743
- Penaloza D., Arias-Stella J. The heart and pulmonary circulation at high altitudes: healthy highlanders and chronic mountain sickness // Circulation, 2007, 115. – p. 1132–1146
- Peng W., Li H., Xia C. et al. Cardiovascular indicators associated with ventricular remodeling in chronic high-altitude disease: a cardiovascular MRI study // European Radiology, 2023, 33 (9). – p. 6267-6277
- Perse C., Leal C., Pinto H. et al. Determinants of acute mountain sickness and success on Mount Aconcagua (6962 m) // High Altitude Medicine and Biology, 2005, 6. – p. 158-166
- Qian Z., Fan A., Dawa D., Pan B. Retrospective cohort analysis of heart rate variability in patients with high altitude pulmonary hypertension in Tibet // Clinical Cardiology, 2020, 43 (3). – p. 298-304
- Reeves J. Chronic mountain sickness // In: Ohno H, Kobayashi T, Masuyama S, Nakashima M, eds. Progress in Mountain Medicine and High Altitude Physiology. Matsumoto, Japan; 1998. – p. 153-159
- Richalet J-P., Larmignat P., Poitrine E. et al. Physiological risk factors for severe high-altitude illness: a prospective cohort study // American Journal of Respiratory Critical Care Medicine, 2012, 185 (2). – p. 192-198
- Ritchie N., Baggott A., Todd W. Acetazolamide for the prevention of acute mountain sickness– a systematic review and meta-analysis // Journal of Travel Medicine, 2012, 19 (5). – p. 298-307
- Santantonio M., Chapplain J-M., Tattevin P. et al. Prevalence of and risk factors for acute mountain sickness among a cohort of high-altitude travellers who received pre-travel counselling // Travel Medicine and Infectious Diseases, 2014, 12 (5). – p. 534-540
- Scherrer U., Rexhaj E., Jayet P-Y. et al. New insights in the pathogenesis of high-altitude pulmonary edema // Progress in Cardiovascular Diseases, 2010, 52 (6). – p. 485-492
- Schneider M., Bernasch D., Weymann J. et al. Acute mountain sickness: influence of susceptibility, preexposure, and ascent rate // Medical Science and Sport Exercise, 2002, 34.– p. 1886-1891
- Schoene R. Illnesses at high altitude // Chest, 2008, 134. – p. 402-416
- Simpson L., Meah V., Steele A. et al. Global REACH 2018: Andean highlanders, chronic mountain sickness and the integrative regulation of resting blood pressure // Experimental Physiology, 2021, 106 (1). – p.104-116
- Singh I., Kapila C., Khanna P. et al. High-altitude pulmonary edema // Lancet, 1965, 191. p. 229-234
- Singh I., Roy S. High altitude pulmonary edema: clinical, hemodynamic, and pathologic studies // In: Command U., Ra D., editors. Biomedicine of high terrestrial elevation problems. Washington D.C, 1969. – p. 108-120
- Sopocles A. High altitude pulmonary edema in Vail, Colorado, 1975-1982 // High Altitude Medicine and Biology, 1986, 144. – p. 569-573
- Steele A., Tymko M., Meah V. et al. Global REACH 2018: volume regulation in high-altitude Andeans with and without chronic mountain sickness // American Journal of Physiology and Regulation Integrated Comperating Physiology, 2021, 321 (3). – R504-R512
- Stembridge M., Ainslie P., Hughes M. et al. Ventricular structure, function, and mechanics at high altitude: chronic remodeling in Sherpa vs. short-term lowlander adaptation // Journal of Applied Physiology, 2014, 117 (3). – p. 334-343
- Swenson S., Maggiorini M., Mongovin S. et al. High altitude pulmonary edema is a non-inflammatory high permeability leak of the alveolar-capillary barrier // JAMA, 2002, 287.– p. 226-235
- Sydykov A., Maripov A., Kushubakova N. et al. An exaggerated rise in pulmonary artery pressure in a high-altitude dweller during the cold season // International Journal of Environmental Research and Public Health, 2021, 18 (8). – 3984
- Tang E., Chen Y., Luo Y. Dexamethasone for the prevention of acute mountain sickness: systematic review and meta-analysis // International Journal of Cardiology, 2014, 173 (2). p. 133-138
- Tang X-G., Zhang J., Qin J. et al. Age as a risk factor for acute mountain sickness upon rapid ascent to 3,700 m among young adult Chinese men // Clinical Interventions in Aging, 2014, 9.– p. 1287-1294
- Tymko M., Tremblay J., Bailey D. et al. The impact of hypoxaemia on vascular function in lowlanders and high altitude indigenous populations // Journal of Physiology, 2019, 597 (24). – p. 5759-5776
- Villafuerte F. New genetic and physiological factors for excessive erythrocytosis and chronic mountain sickness // Journal of Applied Physiology, 2015, 119 (12). – p. 1481-1486
- Wang P., Ha A., Kidd K. et al. A variant of the endothelial nitric oxide synthase gene (NOS3) associated with AMS susceptibility is less common in the Quechua, a high altitude Native population // High Altitude Medicine and Biology, 2010, 11 (1). – p. 27-30
- West J. English translation of “Nomenclature, classification, and diagnostic criteria of high altitude disease in China” // High Altitude Medicine and Biology, 2010, 11 (2). – p. 169-172
- Whayne T. Cardiovascular medicine at high altitude // Angiology, 2014, 65 (6). – p. 459-472
- Wu T-Y., Ding S-Q., Liu J-L. et al. Smoking, acute mountain sickness and altitude acclimatization: a cohort study // Thorax, 2012, 67 (10). – p. 914-919
- Wu Y., Zhang C., Chen Y., Luo Y-J. Association between acute mountain sickness (AMS) and age: a meta-analysis // Military Medical Research, 2018, 5. – p. 14-18
- Xu X., Jing Z. High-altitude pulmonary hypertension // European Respiratory Review, 2009, 18 (111). – p. 13-17
- Ziaee V., Yunesian M., Ahmadinejad Z. et al. Acute mountain sickness in Iranian trekkers around Mount Damavand (5671 m) in Iran // Wilderness and Environmental Medicine, 2003, 14.– p. 214-219
